Zlato
| český název | Zlato |
| latinský název | Aurum |
| anglický název | Gold |
| chemická značka | Au |
| protonové číslo | 79 |
| relativní atomová hmotnost | 196,96654 |
| perioda | 6 |
| skupina | I.B |
| zařazení | přechodné kovy |
| rok objevu | - |
| teplota tání [°C] | 1064,43 |
| teplota varu [°C] | 2808 |
| hustota [g cm-3] | 19,32 |
| hustota při teplotě tání [g cm-3] | 17,31 |
| elektronegativita | 2,54 |
| oxidační stavy | -I, I, III, V |
| elektronová konfigurace | [Xe]4f14 5d10 6s1 |
| atomový poloměr [pm] | 174 |
| kovalentní poloměr [pm] | 144 |
| specifické teplo [J g-1K-1] | 0,128 |
| slučovací teplo [kJ mol-1] | 12,55 |
| tepelná vodivost [W m-1 K-1] | 320 |
| elektrická vodivost [S m-1] | 4,5.107 |
| měrný el. odpor [10-6 Ω.m] | 0,022 |
| 1. ionizační potenciál [eV] | 9,2257 |
| 2. ionizační potenciál [eV] | 20,521 |
| tvrdost podle Mohse | 2,5 |
| tvrdost podle Vickerse [MPa] | 216 |
| tvrdost podle Brinella [MPa] | 2450 |
| modul pružnosti ve smyku [GPa] | 27 |
| modul pružnosti v tahu [GPa] | 78 |
| skupenství za norm. podmínek | s |
Chemické vlastnosti a reakce zlata
Chemický prvek zlato je žlutý, lesklý, na vzduchu stálý a měkký kov.
Zlato je chemicky mimořádně stálý prvek. V běžných kyselinách ani zásadách, se s výjimkou lučavky královské, zlato nerozpouští. Reakcí zlata s lučavkou královskou vzniká chlorid zlatitý AuCl3, při nadbytku HCl je produktem reakce kyselina tetrachlorozlatitá, dobře rozpustné je v kyselině selenové za vzniku selenanu zlatitého Au2(SeO4)3:
Au + 3HCl + HNO3 → AuCl3 + NO + 2H2O
Au + 4HCl + HNO3 → H[AuCl4] + NO + 2H2O
2Au + 6H2SeO4 → Au2(SeO4)3 + 3H2SeO3 + 3H2O
Snadno se rozpouští ve vodném roztoku chloru:
2Au + 3Cl2 + 2H2O → 2H[AuCl3(OH)]
V přítomnosti vzdušného kyslíku se zlato dobře rozpouští také ve zředěných roztocích kyanidů alkalických kovů, thiosíranech a thiomočovině.
Ochotně reaguje s halogeny, s bromem se slučuje již za laboratorní teploty na bromid zlatný AuBr i bromid zlatitý AuBr3, s chlorem reaguje při teplotě do 150°C za vzniku chloridu zlatitého, při teplotě mezi 150-250°C vzniká chlorid zlatný, teprve při teplotách nad 300°C reaguje s fluorem na fluorid zlatitý AuF3. Ještě ochotněji než se samotnými halogeny reaguje zlato s roztoky halogenů v jejich bezkyslíkatých kyselinách. Např. již za normální teploty reaguje s roztokem jodu v koncentrované kyselině jodovodíkové za vzniku komplexní kyseliny tetrajodozlatité, reakce zlata s ostatními halogeny a jejich kyselinami jsou obdobné:
Au + 3I2 + 2HI → 2H[AuI4]
Reakcí zlata s taveninami oxidujících alkalických látek vznikají při teplotě nad 350°C alkalické zlatitany:
Au + NaNO3 → NaAuO2 + NO
Již za laboratorní teploty prudce reaguje s vysoce reaktivním fluoridem bromitým BrF3 za vzniku hexafluorobromitanu zlatitého:
2Au + 4BrF3 → 2Au[BrF6] + Br2
Sloučeniny
Tvoří četné komplexní sloučeniny, zejména s komplexním anionem, sloučeniny s komplexním kationem se vyskytují zřídka, např. dusičnan nebo chroman tetraaminzlatitý [Au(NH3)4](NO3)3, [Au(NH3)4]2(CrO4)3. Ve sloučeninách se zlato vyskytuje téměř výhradně jako trojmocné, ze sloučenin jednomocného zlata je znám např. oxid zlatný Au2O, sulfid zlatný Au2S, kyanid zlatný AuCN a nestabilní chlorid, bromid a jodid. Všechny binární sloučeniny jednomocného zlata jsou ve vodě téměř nerozpustné, naopak velmi dobře rozpustné a v roztocích stabilní jsou komplexní sloučeniny jednomocného zlata. Ze sloučenin pětimocného zlata je znám heptafluorozlatičnan kryptnatý Kr[AuF7], který se připravuje reakcí zlata s extrémně silným oxidačním činidlem fluoridem kryptnatým KrF2:
2Au + 7KrF2 → 2Kr[AuF7] + 5Kr
Tepelným rozkladem heptafluorozlatičnanu při teplotě 60°C je možné získat druhou známou sloučeninu pětimocného zlata fluorid zlatičný AuF5:
2Kr[AuF7] → AuF5 + Kr + F2
Sloučeniny ve kterých vystupuje zlato v oxidačním stupni -I se nazývají auridy. Je znám např. aurid cesný CsAu nebo aurid rubidný RbAu.
Standardní elektrodový potenciál zlata +1,52 V je nejvyšší ze všech prvků a proto v elektrochemické řadě napětí stojí zlato zcela vpravo. Z vodných roztoků svých sloučenin, s výjimkou kyanokomplexů kde je velmi silně vázáno, může být zlato vyredukováno každým ostatním kovem. Výjimky z elektrochemické řady kovů tvoří kadmium, které zlato vyredukuje ve formě nikoliv čistého kovu, ale intermetalické sloučeniny Cd3Au a rtuť, která roztoky zlatitých solí redukuje pouze na soli zlatné.
Analytický důkaz přítomnosti zlatitých iontů v roztoku je možné provést přídavkem roztoku chloridu cínatého SnCl2, přítomnost zlata se projeví intentivním červeným zabarvením (Cassiův purpur), které způsobuje vyredukované kolidní zlato.
Výskyt zlata v přírodě
Průměrný obsah zlata v zemské kůře je 0,004 ppm. Přírodní zlato je tvořeno stabilním izotopem 197Au, uměle bylo připraveno dalších 34 radioaktivních izotopů zlata.
V přírodě se zlato většinou vyskytuje na hydrotermálních křemenných žilách obvykle v doprovodu minerálů antimonu jako ryzí kov s izomorfní příměsí stříbra ve formě drátků, plíšků či valounů a v minerálech calaverit AuTe2, sylvanit (zlatá ruda písmenková) (Au,Ag)2Te4, elektrum (Au,Ag), petzit Ag3AuTe2, nagyagit (zlatá ruda lupenitá) Pb5Au(Te,Sb)4S5-8. Nejvyšší obsah zlata (78,56 % Au) má nerost bezsmertnovit Au4Cu(Te,Pb). Celkem je známo přibližně 30 nerostů s obsahem zlata.
Těžba zlata
Těžba zlata se dnes nejčastěji provádí kyanidovým loužením zlatonosných hornin.
Kyanidové loužení zlata se provádí působením velmi zředěného (0,1-0,2%) roztoku KCN nebo NaCN a vzdušného kyslíku na jemně rozemletou zlatonosnou horninu. Zlato ve formě komplexního kyanidu [Au(CN)2]− přejde do roztoku, ze kterého se posléze vyloučí cementací práškovým zinkem. Ze sraženiny se přebytečný zinek odstraní promýváním zředěnou kyselinou sírovou.
Kyanizace se provádí za normálního tlaku v provzdušňovaných míchaných nádržích nebo za zvýšeného tlaku 2,5 MPa v trubkových autoklávech. Tlakové loužení je oproti atmosférickému podstatně rychlejší. Rozpouštění zlata v roztocích alkalických kyanidů a jeho následnou cementaci zinkem znázorňují rovnice:
4Au + 8KCN + 2H2O + O2 → 4KAu(CN)2 + 4KOH
2KAu(CN)2 + 2Zn + 4KCN + H2O → 2K2Zn(CN)4 + 2Au + 2KOH + H2
Vysušený zbytek se přetaví s boraxem, tavenina obsahuje zlato s příměsí stříbra a platinových kovů. Rafinace zlata se dnes nejčastěji provádí elektrolyticky, elektrolytem je roztok kyseliny tetrachlorozlatité, anodou je surové zlato, katoda je z čistého zlata. Anodové kaly z elektrolytické rafinace zlata jsou zdrojem iridia, rhodia a ruthenia, platina zůstává rozpuštěna v elektrolytu. V minulosti se k oddělení stříbra od zlata používalo promývání vroucí koncentrovanou kyselinou sírovou - afinace, nebo kyselinou dusičnou - kvartace.
Modernější způsob využívá k separaci zlata z kyanidového výluhu iontoměniče, rozšířený je i tzv. CIP proces (carbon in pulp), při kterém se zlato z kyanidového výluhu zachycuje na aktivním uhlí, vyrobeném ze skořápek kokosových ořechů. Z aktivního uhlí se zlato vymývá roztokem 5% NaOH a 2% NaCN. Roztok nasycený zlatem se vede do elektrolyzéru, anodou bývá ocelový plech, katodou je ocelová vlna v plastových koších. Použité aktivní uhlí se po promytí kyselinou chlorovodíkovou aktivuje párou při teplotě 700-900°C, po vychlazení v atmosféře dusíku se aktivní uhlí vrací zpět do procesu.
Pokud obsahuje ruda zvýšený podíl pyritu nebo arsenopyritu, provádí se před vlastním kyanidovým loužením ještě biologické loužení (bioleaching) zlaté rudy. Účelem biologického loužení je rozpuštění sulfidických minerálů, které obklopují zlatou rudu a zhoršují výtěžek kyanidového loužení. Na flotační koncentrát zlaté rudy se působí roztokem termofilních chemolitotrofních bakterií, které získávají energii oxidací anorganických látek. Nerozpustné sulfidy se oxidují na rozpustné sulfáty, účinnost kyanidového loužení se tímto postupem zvyšuje až na 95 %.
Bylo patentováno několik technologií biologického loužení zlatých rud, některé způsoby se provádějí v tancích, jiné na volných hromadách. První závod na biologické loužení byl v roce 1986 uveden do provozu ve Fairview v JAR. Největší závod s kapacitou 960 t biologicky zpracovaného koncentrátu denně, provozuje od roku 1994 jihoafrická společnost Gold Fields v Sansu v Ghaně. Menší provozy jsou v činnosti v Austrálii, Brazílii, Číně , Peru i jinde.
Jako velice perspektivní se jeví thiomočovinové loužení zlata, při kterém se jako loužící činidlo používá vodný roztok thiomočoviny CS(NH2)2.
K získávání z hornin, ve kterých se zlato vyskytuje ve větších částečkách, se využíval amalgamový způsob získávání zlata. Na rudný koncentrát se působilo rtutí, zlato vytvoří amalgam, ze kterého se posléze oddestiluje rtuť. Do objevu kyanidového způsobu (1886), byl používán chlorační postup získávání zlata, který spočíval v působení chloru na vlhkou zlatonosnou horninu. Zlato přešlo do roztoku jako rozpustný chlorid zlatitý a bylo vysráženo síranem železnatým nebo sirovodíkem.
Produkce a zásoby
V roce 2012 dosáhla světová těžba zlata úrovně 2,7 kt. Největším producentem zlata byla Čína (370 t), Austrálie (250 t), USA (230 t), Rusko (205 t), JAR (170 t), Peru (165 t), Kanada (102 t) a Indonésie (100 t). Celosvětové zásoby zlata jsou 52 kt. Největší naleziště zlata jsou v Austrálii, JAR, Rusku, Chile, USA a Brazílii. Největším evropským producentem zlata je s roční těžbou 6,3 t Švédsko, 5,6 t produkuje Finsko a 4,5 t zlata se vytěžilo v Bulharsku.
Zásoby zlata v ČR činí celkem 239 t, z toho 48,7 t tvoří bilanční prozkoumané zásoby a 28,6 t jsou bilanční vyhledané zásoby. Prognózní zdroje zlata v ČR obsahují dalších 75 t kovu v rudě. Na našem území je evidováno celkem 15 ložisek zlata, nejvíce nalezišť (7) se nachází ve středních Čechách.
Mapa ložisek zlata v ČR:
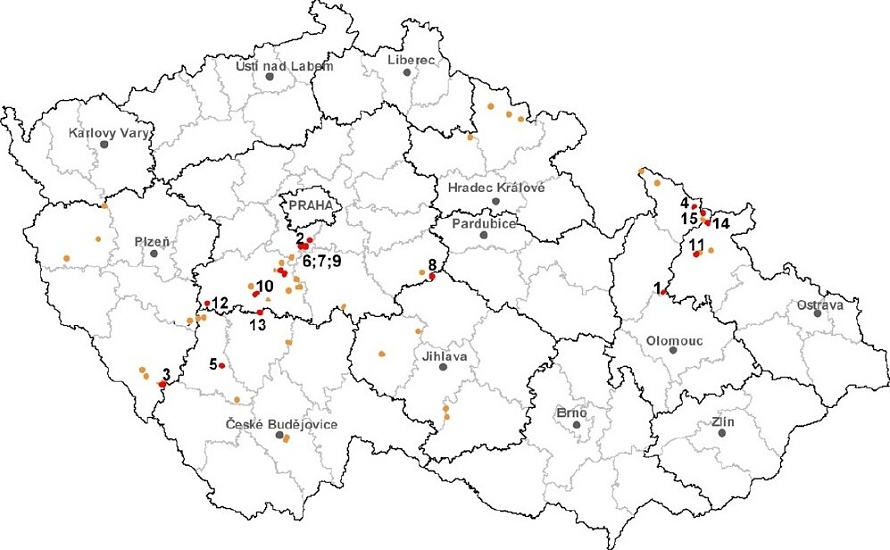
Mapa evidovaných ložisek zlata v ČR:
1-Břevenec, 2-Jílové u Prahy, 3-Kašperské Hory, 4-Mikulovice u Jeseníka, 5-Modlešovice, 6-Mokrsko, 7-Mokrsko-východ,
8-Podmoky, 9-Prostřední Lhota-Čelina, 10-Smololety-Horní Líšnice, 11-Suchá Rudná-střed, 12-Vacíkov,
13-Voltýřov,
14-Zlaté Hory-východ, 15-Zlaté Hory-Zlatý potok.
Využití
Zlato se nejčastěji využívá k výrobě šperků, elektrických kontaktů, v zubním lékařství a k pozlacování předmětů z méně ušlechtilých kovů. Jako potravinářské barvivo E 175 se využívá k barvení čokolád, likérů a cukrovinek. V klenotnictví se obvykle využívá zlato ve formě slitin s dalšími kovy, slitina se stříbrem nebo zinkem je známá jako žluté zlato, slitina s niklem či palladiem je bílé zlato, slitina s mědí je červené zlato, slitina s kadmiem je zelené a slitina s kobaltem je modré zlato. Slitina zlata s indiem má zajímavé fyzikální vlastnosti, dokonale smáčí sklo a využívá se proto k utěsňování skleněných průzorů kosmických lodí. Slitina s germaniem je využívána jako klenotnická pájka. Chlorid zlatitý AuCl3 je výchozí látkou pro přípravu Cassiova purpuru, který slouží k barvení skla na červeno, dikyanozlatnan draselný K[Au(CN)2] se používá k přípravě zlatících galvanických lázní, tetrachlorozlatitan sodný Na[AuCl4] se používal ve fotografické chemii, fluorid zlatitý AuF3 se používá jako silné fluorační činidlo. Zlato je nejdůležitější investiční kov.
Aktuální cena zlata
Zdroje
- BARTHELMY, David. Mineral Species containing Gold. In: Mineralogy database [online]. 2010 [cit. 2012-08-07]. Dostupné z: http://webmineral.com/
- BOROVEC, Zdeněk et al. Úvod do biotechnologie nerostných hmot. Praha: SPN, 1990.
- BRITISH GEOLOGICAL SURVEY. 2012. European Mineral Statistics 2006-10. Keyworth, Nottingham: British Geological Survey. ISBN 978-0-85272-698-3
- GEORGE, Micheal. Gold. In: U.S. GEOLOGICAL SURVEY. Mineral Commodity Summaries [online]. 2013 [cit. 2013-02-27]. Dostupné z: http://minerals.usgs.gov/
- HUSTED, Robert; et al. Gold. In: LOS ALAMOS NATIONAL SECURITY. Los Alamos National Lab [online]. 2011 [cit. 2012-05-05]. Dostupné z: http://periodic.lanl.gov/
- MELLOR, Joseph. Comprehensive Treatise on Inorganic and Theoretical Chemistry. Vol. 3. Londýn: Longmans, Green & Co., 1923.
- MORÁVEK, Petr. Můžeme u nás těžit zlato? In: Asociace České zlato [online]. 2010 [cit. 2012-09-23]. Dostupné z: http://www.ascez.cz/
- MORÁVEK, Petr, et al. Zlato v Českém masívu. Praha: Český geologický ústav, 1992. ISBN 80-7075-088-X.
- NOVÁK, František; JANSA, Jiří. Zlato v cenomanských sedimentech severočeské křídy. Liberec: Sborník Severočeského Muzea. Přírodní vědy. 14/1985.
- REMY, Heinrich. Anorganická chemie - II. díl. 2. české vydání, dotisk. Praha: SNTL, 1972, s. 419-431
- STARÝ, Jaromír; et al. Surovinové zdroje České republiky - Nerostné suroviny 2012. Praha: Česká geologická služba, 2012. ISBN 978-80-7075-804-5.